ВЗАИМОДЕЙСТВИЕ ПОВЕРХНОСТЕЙ ТВЕРДЫХ ТЕЛ С ОКРУЖАЮЩЕЙ СРЕДОЙ
Молекулы окружающей среды в процессе беспорядочного теплового движения сталкиваются с поверхностью твердого тела и вступают с ней во взаимодействие, высаживаясь преимущественно на активных центрах поверхности, т.е. на участках, где выходят на поверхность ребра и грани кристаллитов, дефекты атомной решетки — дислокации, инородные атомы и т.д., что обеспечивает повышенную избыточную (свободную) поверхностную энергию, и где поэтому взаимодействие с высадившимися молекулами протекает более активно. В результате концентрация молекул окружающей среды (называемой в этом случае адсорбатом) у поверхности твердого тела (в данном случае адсорбента) становится больше, чем в объеме жидкой или газообразной фазы. Такой процесс называется положительной адсорбцией (или просто адсорбцией). Проходит он самопроизвольно, так как обеспечивает снижение энергии Гиббса поверхности, уменьшая ее поверхностное натяжение, а следовательно, уменьшая опасность адгезии поверхностей в узле трения. При этом в поверхностный слой предпочтительнее попадают молекулы того компонента среды, который более снижает межфазное поверхностное натяжение. Тогда об этом веществе говорят, что оно более поверхностно-активно.
Наибольшую поверхностную активность проявляют полярные молекулы среды, т.е. молекулы, имеющие жесткий дипольный момент. В смазочных материалах содержится определенное число молекул, представляющих собой полярную группу (или несколько таких групп), соединенную с углеводородным радикалом. Эти молекулы высаживаются на поверхности металла полярной группой к поверхности. Следует иметь в виду, что в результате эмиссии электронов с поверхности металлов приповерхностные слои обеднены электронами. Это обусловливает существование двойного электрического слоя. У свободной поверхности образуется область отрицательного заряда, а в приповерхностном объеме металла — положительного. В результате взаимодействия этого двойного электрического слоя с полярной группой адсорбирующихся молекул на поверхности образуется ориентированный мономолекулярный (толщиной в одну молекулу) слой адсорбированных молекул. Углеводородный радикал у каждой из таких молекул при полностью заполненном (насыщенном) адсорбционном слое направлен по нормали от поверхности раздела фаз, так что образуется своеобразный частокол, покрывающий эту поверхность, причем адсорбция имеет место на активных центрах поверхности. Адсорбированные молекулы связаны между собой межмолекулярными силами когезии, которые так велики, что позволяют говорить об ориентированном слое как о двумерном кристалле.
Затем поверх мономолекулярного слоя адсорбируются следующие ориентированные слои молекул до тех пор, пока общая толщина слоя не будет превышать радиус действия поверхностных сил (рис. 1, а). Предполагается, что эти силы достаточны, чтобы удержать слой толщиной в десятки и сотни нанометров. Поскольку поверхностные силы ослабевают пропорционально третьей или четвертой степени расстояния, то каждый поверхностный слой связан с металлом меньше, чем предыдущий. За пределами граничного слоя возникают переходные слои, образующиеся благодаря слабым взаимодействиям между адсорбированными молекулами (т.е. их концевыми углеводородными группами) и молекулами среды или агрегатами молекул, так как в смазочных материалах —жидких или пластичных — молекулы, как правило, находятся в агрегированном состоянии. Если силы взаимодействия с поверхностью больше, чем силы, связывающие молекулы в агрегаты, то эти агрегаты разрушаются и молекулы адсорбируются на поверхности раздела или на уже образовавшихся адсорбционных слоях. В противном случае, как показал Г.И. Шор, такие агрегаты (мицеллы) могут образовывать граничный слой (мицеллярная адсорбция) (рис. 1, б). По мнению Блюма, мицеллы образуют граничный слой поверх адсорбированного (рис. 1, в). Ниже рассматривается модель молекулярной адсорбции как наиболее разработанная.
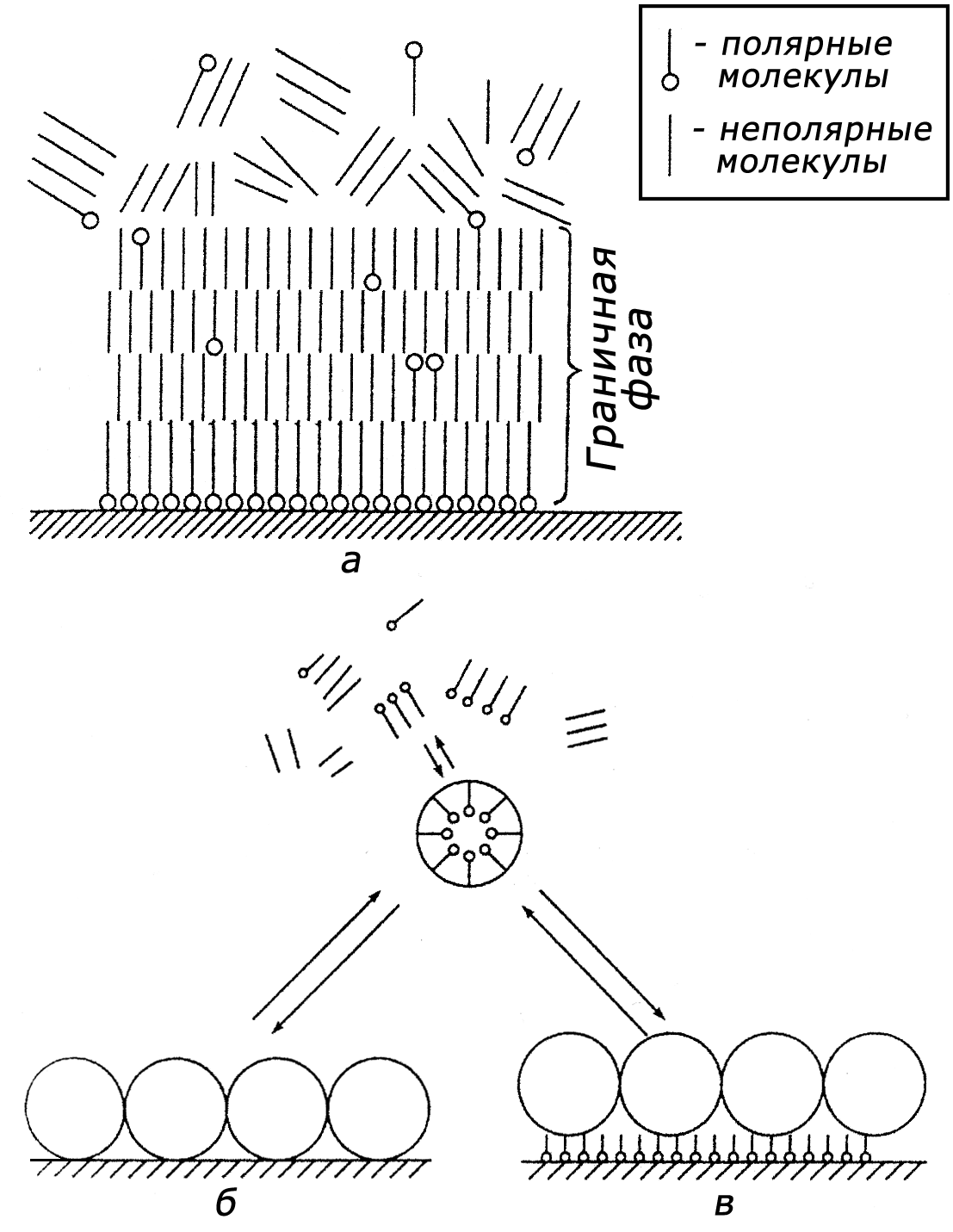
Рис. 1. Строение граничного адсорбционного слоя: а — по Дерягину; б — по Шору; в — по Блюму.
Неполярные молекулы также могут образовывать граничный слой, поскольку поверхность металла индуцирует в них дипольный момент. Однако связь их с поверхностью существенно менее прочна. Если в состав среды входят как полярные, так и неполярные компоненты, то полярные молекулы, образуя адсорбированный ориентированный слой, сообщают ту же ориентацию неполярным молекулам (см. рис. 1, а).
Граничные слои на поверхности твердого тела по своим свойствам резко отличаются от свойств среды в объеме. Согласно А.С. Ахматову, они подобны твердому кристаллическому телу (ориентация частиц), а также обладают истинной упругостью формы (подчиняются закону Гука). Граничные слои обладают высоким сопротивлением сжатию и много меньшим — сдвигу. Как показал Б.В. Дерягин, вязкость граничных слоев существенно выше, чем объемная, причем при переходе к граничному слою вязкость повышается скачкообразно.
Процесс обратный адсорбции, т.е. уход адсорбированных молекул с поверхности в окружающую среду, называют десорбцией. Если адсорбция — процесс самопроизвольный и происходит с выделением тепла (т.е. экзотермически), причем количество выделившегося тепла характеризует прочность связи адсорбированных молекул с поверхностью, то десорбция — всегда активируемый процесс, т.е. для его реализации необходимо «подвести» определенную энергию. Часть адсорбированных молекул вследствие тепловых флуктуаций как их самих, так и адсорбировавшей их поверхности приобретает эту энергию и покидает поверхность, уходя в объем жидкой или газообразной фазы. В то же время из этой фазы на поверхности твердого тела адсорбируются новые молекулы. Таким образом, содержание молекул среды в поверхностном слое в каждый момент определяется соотношением между одновременно идущими процессами адсорбции и десорбции. Чем больше поверхностная активность молекул среды, тем прочнее их связь с поверхностью, тем больше время пребывания каждой молекулы в адсорбированном состоянии.
В научной литературе рассматривают два вида адсорбции:
- физическая (обратимая) адсорбция возникает под действием сил Ван-дер-Ваальса и рассмотрена выше. Энергия связи молекул с поверхностью невелика (от 5-10 кДж/моль для простых молекул и до 40-80 кДж/моль для сложных молекул);
- химическая адсорбция (хемосорбцня) возникает под действием химической связи между поверхностными частицами твердого тела и молекулами среды. Энергия связи хемосорбированной молекулы с поверхностью выше, чем при физической адсорбции и сравнима с энергией химической реакции (40-400 кДж/моль). Хемосорбция обычно требует определенной энергии активации и поэтому протекает при температурах, превышающих некоторую минимальную температуру.
Физическая адсорбция, наоборот, уменьшается с ростом температуры. Другое отличие хемосорбции от физической адсорбции состоит в том, что первая образует двумерную фазу и прекращается после заполнения мономолекулярного слоя. Поверх хемосорбированного слоя молекул возможна многослойная физическая адсорбция молекул среды.
Следует иметь в виду, что адсорбция, связанная с химическим взаимодействием, не обязательно имеет следствием снижение поверхностной энергии твердой фазы.
Дальнейшей стадией взаимодействия поверхности твердого тела с активными компонентами среды является химическая реакция с образованием химически модифицированного слоя на поверхности раздела. В отличие от хемосорбции, химическая реакция приводит к образованию слоя продукта этой реакции, иначе говоря — трехмерной фазы.
Характерным примером взаимодействия поверхностей твердых тел со средой является их окисление.
Практически все поверхности твердых тел, в частности металлов, начиная с момента своего образования, контактируют с воздухом. Активный компонент воздуха — кислород — хемосорбируется на поверхности металла. Здесь его двухатомная молекула диссоциирует, так как энергия взаимодействия с поверхностью больше энергии связи атомов в молекуле. Затем кислород реагирует с поверхностью, образуя пленки оксидов, как правило, кристаллического строения. Скорость образования оксидов достаточна высока. На таких металлах, как Fe, Cu, Al, менее чем через 5 мин после обработки резанием уже при комнатной температуре образуется пленка толщиной до 10 нм, причем при росте температуры скорость образования оксидной пленки увеличивается. Покрывая поверхности металла слоем, толщина которого больше радиуса действия сил притяжения, действующих между твердыми телами, оксиды улучшают фрикционно-износные характеристики сопряжения, поскольку адгезия оксидных пленок намного меньше адгезии между атомарно чистыми поверхностями металлов.
Необходимо отметить одно важное следствие адсорбции поверхностно-активных сред на поверхностях твердых тел. Академик П.А. Ребиндер установил, что при этом происходит пластифицирование тончайшего (глубиной порядка 0,1 мкм) поверхностного слоя твердых тел (как металлов, так и неметаллов), облегчение его деформируемости, снижение его прочности (возникновение хрупкого разрушения, при малых напряжениях вплоть до самопроизвольного диспергирования) и твердости. Этот эффект (называемый в научной литературе «эффектом Ребиндера») оказывает значительное влияние как на обработку резанием и давлением, облегчая эти технологические процессы, так и на процесс трения. Термодинамически эффект Ребиндера может быть объяснен снижением свободной поверхностной энергии твердых тел в результате адсорбционного воздействия поверхностно-активных сред.
Пластифицирующее действие адсорбционно-активных сред проявляется в облегчении выхода дислокаций на поверхность и зарождении поверхностных источников дислокаций. Кроме внешней формы проявления эффекта Ребиндера выделяют его внутреннюю форму, которая определяется адсорбцией поверхностно-активных веществ на внутренних поверхностях раздела зародышевых микротрещин, образующихся в результате деформирования твердых тел. Это облегчает развитие микротрещин («расклинивающий» эффект) и приводит к хрупкому разрушению твердого тела. Эффект Ребиндера проявляется при совместном воздействии поверхностно-активной среды и напряженного состояния. Так, по данным Г.И. Фукса, в поверхностно-активных средах уменьшается твердость на вдавливание тончайших поверхностных слоев металла. Адсорбционную активность проявляют, в частности, углеводороды с различными полярными группами (в порядке убывания адсорбционной способности): -OH, -COOH, -NH2, -COOR. При этом большее снижение поверхностной прочности обеспечивают вещества с короткой углеводородной цепью, что, по-видимому, позволяет им легче проникать в микротрещины. Значительную адсорбционную активность проявляют расплавы легкоплавких металлов по отношению к более тугоплавким.
Пластическая деформация в процессе обработки металлов давлением и резанием значительно увеличивает физико-химическую активность поверхностных слоев. Это в значительной степени определяет строение и свойства образуемых на поверхности деталей слоев, кинетику физической и химической адсорбции и химического взаимодействия. При деформации металлов (упругой или пластической), согласно Ван-Бюрену, практически вся запасенная в этом процессе энергия расходуется на образование или на увеличение энергии взаимодействия дефектов решетки. Так, концентрация дефектов, характеризующая неравновесное состояние металла при 10%-ной деформации, достигает 1018—1019 см-3. Исследования показывают, что структура поверхностного слоя металла уже после технологической обработки представляет собой ряд слоев (рис. 2), расположенных в следующем порядке (от поверхности в глубь металла): 1 — слой, состоящий из загрязнений (адсорбированных из смазочно-охлаждающей жидкости и т.д.); 2 — слой адсорбированного газа; 3— слой окисла; 4 — упрочненный во время механической обработки слой, состоящий из сильно деформированных под действием нормальных и тангенциальных усилий зерен; 5 — металл с исходной структурой.
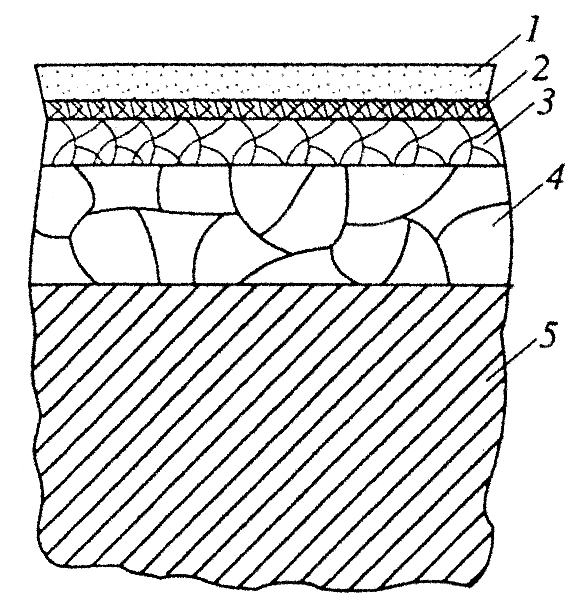
Рис. 2. Структура поверхностного слоя шлифованной стальной детали.
Физико-химические свойства поверхностных слоев металлов определяются процессами, имеющими место при механической обработке (упрочнение вследствие пластических деформаций — наклеп, разупрочнение вследствие влияния температур, генерируемых при обработке, — отпуск); физической адсорбции и хемосорбции с учетом адсорбционного понижения прочности (наиболее интенсивно проявляется при растягивающих напряжениях, создаваемых в материале, что характерно при трении скольжения). В самом общем случае изменения твердости тончайших поверхностных слоев по глубине в условиях технологической обработки и в условиях внешнего трения имеют вид, приведенный на рис. 3.
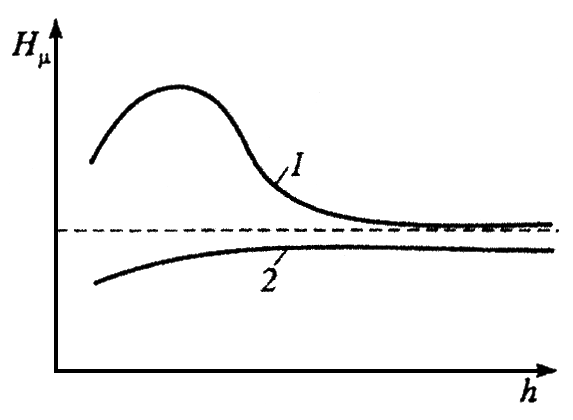
Рис. 3. Изменение микротвердости Нμ поверхностного слоя металла в зависимости от расстояния h от поверхности вглубь металла: 1 — после технологической обработки; 2 — после эксплуатации.
Согласно сформулированному И.В. Крагельским правилу положительного градиента механических свойств металлов по глубине, внешнее трение (в отличие от внутреннего трения, при котором имеет место разрушение поверхностных и более глубоко лежащих слоев трущихся тел) имеет место в том случае, когда dHμ/dH > 0. Обеспечение положительного градиента механических слоев по глубине может быть осуществлено в процессе технологической обработки (например, путем нанесения тонких пленок металла или полимера, более мягкого, чем основной металл), либо путем адсорбции или хемосорбции молекул активных компонентов смазочных материалов, либо путем введения между трущимися телами твердого, жидкого или газообразного материала, менее прочного на сдвиг, чем материал трущихся тел.
Литература
- Доценко А.И., Буяновский И.А. / Основы триботехники. Учебник. - М.: Инфра-М, 2014.
- Бакли Д. Поверхностные явления при адгезии и фрикционном взаимодействии - М.: Машиностроение, 1986.
- Фетисов Г.П. Материаловедение и технология металлов. М.: Высшая школа, 2008.
- Фролов Ю.Г. Курс коллоидной химии (поверхностные явления и дисперсные системы): Учебник - М.: Химия, 1982.
- Смазочные материалы. Антифрикционные и противоизносные свойства. Методы испытаний: Справочник/ Р.М.Матвеевский, В.Л. Лашхи, И.А. Буяновский и др. - М.: Машиностроение, 1989.
- Чичинадзе А.В., Берлинер Э.М., Браун Э.Д. и др. Трение, износ и смазка (трибология и триботехника) - М.: Машиностроение, 2003.
- Крагельский И.В., Михин Н.М. Узлы трения машин. - М.: Машиностроение, 1984.
